|
Eräässä
viimeisimmistä artikkeleistaan Ron Shimek todisti, miten kaksi
synteettistä suolasekoitusta ja luonnon merivesi olivat
huomattavasti parempia kuin kaksi muuta testattua suolasekoitusta
tutkittaessa merisiilien alkioiden selviytyvyyttä. Artikkelissaan
Shimek ehdotti erääksi mahdolliseksi selitykseksi kohonneita
metallipitoisuuksia (kuten kupari). Suoloissa, joissa alkioiden kehitys
oli huonoa, on raportoitu olevan korkeammat myrkyllisten metallien
pitoisuudet kuin kahdessa paremmin menestyneessä suolassa ja
luonnon merivedessä.
Vaikka muita mahdollisia
selityksiä onkin olemassa, kuten ammoniakki, nitriitti, pH,
orgaaniset yhdisteet (joko tarkoituksellisesti lisättyinä tai
epäpuhtauksina) ja monien epäorgaanisten kemikaalien nousseet
tai laskeneet pitoisuudet, on hypoteesi myrkyllisistä metalleista
varsin varteenotettava. Edellä mainitun ja aiempien artikkeleiden
vaikutuksesta monet harrastajat ovat kiinnostuneita
löytämään keinon em. metallien pitoisuuksien
laskemiseksi akvaarioissaan. Tämän artikkelin
lähtökohtana on, että Shimekin havaitsemat biologiset
vaikutukset johtuivat myrkyllisistä metalleista ja pyrin
esittämään joitain ratkaisuja tähän onglemaan.
Jotkut ovat ilmeisen
virheellisesti olettaneet, että käyttämällä
luonnon merivettä tai matalamman metallipitoisuuden
synteettistä suolaseosta ongelma voitaisiin ratkaista.
Valitettavasti jotkut toimenpiteet joita jokainen akvaristi joutuu
käyttämään akvaarionsa ylläpidossa voivat olla
pääasiallinen metallien lähde. Erityisesti ruuat
sekä kalsium- ja alkaliniteetti lisäykset ovat suuri metallien
lähde riutta-akvaariossa. Koska näiden
välttämättömien komponenttien lisäys muodostaa
monimutkaisen kokonaisuuden, on hyvin vaikeaa, ellei mahdotonta,
ylläpitää luonnollisia metallipitoisuuksia
akvaariovedessä. Sekä ruuissa että lisäaineissa on
tarpeeksi metalleja nostamaan kohtuullisen nopeasti luonnollisen
meriveden "korkean metallipitoisuuden" suolaseoksen tasolle.
Tätä mahdollisuutta tukee se, että Shimekin tutkimuksessa
mukana olleen luonnollista merivettä käyttävän
akvaarion metallipitoisuudet olivat eräät korkeimmista
tutkituista. Saman havaitsi Habib Sekha tutkiessaan kahta luonnollista
merivettä käyttävää akvaariota; nikkeli- ja
kuparipitoisuudet olivat samankaltaisia kuin Shimekin tutkimissa
synteettisiä suolaseoksia (kuten Instant Ocean)
käyttävissä akvaarioissa. Näiden altaiden
kuparipitoisuudet olivat myös lähellä oman altaani
(Instant Ocean) vettä (10-13 ppb).
Lisäksi voisi olettaa,
että erilaisten metallien määrä olisi huomattavan
erilainen eri akvaarioissa johtuen suuresti vaihtelevista
hoitomenetelmistä. Kuitenkin kaikkien tutkittujen akvaarioiden
kuparipitoisuudet olivat suhteellisen lähellä toisiaan.
Tämä antaa olettaa että pitoisuuksia paremminkin
kontrolloi akvaariosta ulos tuleva kuin sisään menevä
metallien määrä. Käsittelen tätä
mahdollisuutta ja sen vaikutusta hoitorutiineihin artikkelin loppuosassa.
Keskityn tässä
artikkeleissa niihin mahdollisesti myrkyllisiin metalleihin, joiden
pitoisuuksien on havaittu olevan akvaarioissa korkealla. Tällaisiin
metalleihin kuuluvat mm. kupari, nikkeli, sinkki, molybdeeni ja
koboltti. Oletan myös, että akvaristi haluaa pitää
tällaisten metallien pitoisuudet matalina. Annan ohjeita ja
yleisempää informaatiota siitä, miten akvaristi voi
päästä tähän tavoitteeseen. Joissain
tapauksissa nämä tekniikat vaikuttavat useiden metallien
ryhmään ja joissain tapauksissa vain tiettyihin metalleihin,
kuten kupariin.
Harrastajilla on mahdollisuus
ylläpitää huomattavasti matalampia metallipitoisuuksia
tässä ja tulevissa artikkeleissa kuvatuilla
toimenpiteillä. Se, kuinka suuri merkitys tällä on
akvaarion hyvinvoinnin kannalta voidaan nähdä vasta kun
päästään vertailemaan vanhaa ja uutta.
Tämän jälkeen jokainen harrastaja voi itse tarkistella
tuloksia ja päättää, ovatko nämä
toimenpiteet tarpeellisia ja/tai mielekkäitä.
Aluksi on todettava, että
tähän ongelmaan ei ole olemassa yksinkertaisia ratkaisuja.
Kaksi itsestään selvää ratkaisua kuitenkin on:
lisää vähemmän ja poista enemmän. Akvaristi voi
vähentää akvaarioon tulevien myrkyllisten metallien
määrää tässä artikkelissa myöhemmin
kuvatuilla tavoilla. Riippuen tulevien metallien
määrästä, "normaalit" poistumisreitit (vaahdotus,
leväkasvu, aktiivihiili jne.) voivat olla tarpeeksi tehokkaita
kompensoimaan eri tavoin lisättyjen myrkkyjen
määrää. Harrastajien saatavilla on myös muita
"kemiallisia suodatusmetodeja", mutta on kyseenalaista, voivatko ne
pudottaa metallien määrää alle olemassa olevien
pitoisuuksien, riippumatta systeemiin sisään tuotavien
metallien määrästä. Muita, kuitenkin vielä
kyseenalaisia, mahdollisuuksiakin löytyy, kuten metallien sitominen
kalsiumkarbonaattiin. Näitä tutkitaan tarkemmin
artikkelisarjan myöhemmissä osissa.
Jotta voimme paremmin arvioida
eri toimenpiteiden vaikutusta akvaariossa, on meidän myös
ymmärettävä hieman tarkemmin niitä eri muotoja,
joissa eri metallit esiintyvät akvaariovedessä. Monet
harrastajat pitävät itsestään selvänä,
että nämä metallit ovat enemmän tai
vähemmän samassa muodossa kuin esimerkiksi kalsium, eli
vapaina ioneina kellumassa vesimolekyylien seassa. Todellisuudessa
tilanne monien metallien osalta on huomattavasti monimutkaisempi.
Esimerkiksi kuparista yli 99.9% on sitoutuneena johonkin muuhun ja se,
mihin se on sitoutunut, vaikuttaa merkittävästi kuparin
käyttäytymiseen. Tästä johtuen tarkastelemme ensin,
missä muodossa metallit esiintyvät merivedessä ja
missä muodossa niiden voidaan olettaa akvaariovedessä
esiintyvän.
Metallit merivedessä ja akvaariossa
Merivedessä erilaiset
metallit esiintyvät eri muodoissaan. Toiset esiintyvät
pääasiallisesti vapaina ioneina; tällaisia ovat
esimerkiksi natrium (Na+), kalium (K+), kalsium (Ca++)
ja magnesium (Mg++).
Kaikki edellä mainituista voivat joissain määrin
muodostaa yhdisteitä muiden ionien ja orgaanisten aineiden kanssa
mutta ne esiintyvät kuitenkin aina pääasiallisesti
vapaina ioneina.
Kuitenkin ne metallit, joita
tässä artikkelissa pääasiassa
käsitellään, käyttäytyvät merivedessä
huomattavasti monimutkaisemmin. Esimerkiksi kupari esiintyy huomattavan
monessa muodossa.4 Viimeaikoina on
käynyt selväksi, että kupari on lähes kokonaan
sitoutunut orgaanisiin aineisiin.5Monia
näistä orgaanisista yhdisteistä kutsutaan
kelaattoreiksi. Kelaattori on yhdiste, joka kykenee
yhdistymään esimerkiksi kupariin yhtäaikaa kahdesta eri
suunnasta. Kelaattorin ja metalin yhdistelmää kutsutaan
kelaatiksi.
Tällaiset orgaaniset
yhdisteet esiintyvät luonnossa monenlaisessa muodossa. Esimerkiksi
humus- ja fulvohapot ovat tärkeimpiä kuparia ja muita
metalleja sitovia yhdisteitä.6
Niiden tiedetään myös merkittävästi
vähentävän metallien myrkyllisyyttä, sillä
nimenomaan vapaa kupari on kaikkein myrkyllisintä.5
Näitä yhdisteitä muodostuu, kun proteiinit,
hiilihydraatit ja monet muut luonnossa esiintyvät orgaaniset
yhdisteet hajoavat biologisesti tilaan, jossa hajoaminen hidastuu
erittäin hitaaksi. Humus- ja fulvohapoppoja (näiden ero on se,
että humushapot ovat enemmän hydrofobisia kuin fulvohapot) on
laaja valikoima erilaisine rakenteineen ja fysiologisine
ominaisuuksineen. Tyypillisesti ne ovat orgaanisia happoja ja
niillä on suuri molekyylipaino, koon vaihdellessa 500-10000
daltonin välillä. Ne voivat myös olla osa suurempaa
molekyyliyhdistelmää joita kutsutaan kolloideiksi. Humus- ja
fulvohapot koostuvat aminohapoista, sokereista, aminosokereista,
rasvahapoista ja muista funktionaalisista ryhmistä. Ne
esiintyvät eri muodoissa ja pitoisuuksissa riippuen sijainnista ja
syvyydestä. Tyypillisessä trooppisessa merivedessä on
pinnan tuntumassa noin 1 ppm liuennutta orgaanista hiiltä.6 Tästä noin 10-20% on
humushappoja ja jopa yli 50% fulvohappoja.6
Näissä
yhdisteissä on kohtia, joissa karboksyylihapot, fenyylialkoholit,
tiolaatit ja aminoryhmät yhdistyvät. Näihin kohtiin
metalli ionit sitoutuvat kaikkein voimakkaimmin. On hyvin vaikeaa
näyttää rakenteellisesti "tyypillistä" humushappoa,
johon on kupari sitoutunut, alla kuitenkin yksi mahdollisuus:
Kuva 1. Kupari ionin ja humushapon
muodostama kelaatti.
Tässä kuvassa kupari
ioni on kelatoitunut suurempaan humushappoon (vihreä). Kuvassa
kupari on sitoutunut kahteen negatiivisesti varautuneeseen
karboksyylihapporyhmään sekä yhteen neutraaliin
aminoryhmään. Yhdessä nämä kolme
ryhmään muodostavat useita kertaluokkia voimakkaamman sidoksen
kuin yksikään ryhmä yksinään pystyisi.
Lainaus erittäin laajasta
"Biogeochemistry of Marine Dissolved Organic Matter"6
teoksesta:
"It is now widely accepted that
the chemical speciation of most bioactive metals in seawater is
regulated by strong complexation with natural organic chelators…The
cycling of bioactive metals therefor is intrinsic to the behavior of
this subset of organic constituents."
sekä:
"The collective findings establish that a significant component of
bioactive, or nutrient, metals (Mn, Fe, Co, Ni, Cu, Zn, Cd) occur in the
colloidal phase along with numerous other trace metals."
Vapaat metalli ionit
Merivedessä kuparin
oletetaan sitoutuvan orgaanisiin aineisiin. Eräässä
tuoreessa tutkimuksessa havaittiin että yli 99.97% kuparista on
sitoutuneena oragaanisiin aineisiin.5
Muut metallit, kuten sinkki, eivät välttämättä
ole yhtä runsaasti kelatoituneet. Kuitenkin akvaariovedessä,
jossa on enemmän sekä orgaanisia yhdisteitä että
metalleja, voi metallien sitoutuminen olla jopa runsaampaa. Joka
tapauksessa kelatoitumattomat metallit ovat erittäin
tärkeitä. Esimerkiksi kuparin tapauksessa vapaat kupari ionit
voivat muodostaa juuri sen osan kaikesta kuparista, joka on
myrkyllistä monille eliöille.5
Nämä epäorgaaniset kupariyhdisteet ja muut metallit ovat
oletettavasti pääasialliset muodot juuri sekoitetussa
keinotekoisessa merivedessä joka ei vielä ole
päässyt kosketuksiin orgaanisten aineiden kanssa.
Jos oletamme, että
eliö ei kuluta kokonaan orgaanista molekyyliä, johon metalli
on sitoutunut, kelatoituneet metallit ovat paljon vähemmän
myrkyllisiä kuin kelatoitumattomat. Useiden humus- ja fulvohappojen
tiedetään olevan erittäin vaikeasti eliöiden
käytettävissä. Merivedessä on paljon
tärkeämpää tietää, mihin ja missä
määrin metalli on kelatoitunut kuin se, miten paljon sitä
kaiken kaikkiaan on.7
Myös kelatoitumattoman
metallin eri epäorgaaniset muodot voivat olla monimutkaisia.
Esimerkiksi kupari esiintyy merivedessä vähintään
seitsemässä eri epäorgaanisessa muodossa.4
Näitä ovat Cu++ (3.9%
epäorgaanisesta kuparista), CuOH+
(4.9%), Cu(OH)2 (2.2%), CuSO4
(1%), CuCO3 (73.8%), Cu(CO3)2-- (14.2%) ja Cu(HCO3- )+
(0.1%). Myös monet muut meitä kiinnostavat metallit
esiintyvät yhtäläisen monimutkaisina muotoina.4
Eri kemiallisten muotojen merkitys
metallien sitomiseen akvaariossa
Koska siis edellä mainitut
metallit esiintyvät akvaariovedessä mitä moninaisimmissa
muodoissa, tulee meidän ottaa huomioon näiden eri
esiintymismuotojen ominaisuudet suunnitellessamme mahdollisia tapoja
poistaa niitä. Esimerkiksi metalli-ionit kuten Cu++
tai Ni++ eivät missään
tilanteessa poistu suoraan vaahdotuksen avulla koska ne eivät tartu
vesi/ilma rajapintaan. Kuitenkin, jos edellä mainitut metallit ovat
osana jotakin orgaanista yhdistettä, voidaan niitä hyvin
poistaa vaahdotuksella. Samanlaisia asiaoita on huomioitava kun
käytetään esim. aktiivihiiltä, erilaisia
polymeerejä tai epäorgaanisia aineita (kuten raudan oksidit
tai kalsiumkarbonaatti) metallien sitomiseen. Itse asiassa
kaikkiin erilaisiin poistomenetelmiin vaikuttaa olennaisesti metallin
esiintymismuoto. Asiaa vaikeuttaa edelleen se, että eri
akvaarioissa eri metallit voivat esiintyä erilaisissa muodoissa
(riippuen siitä, miten ne alunperin ovat akvaarioon tulleet).
Näin ollen yleispäteviä ohjeita on vaikea antaa.
Lisäksi eri tuotteita
testattaessa on otettava huomioon todelliset akvaario-olosuhteet: jos
testit tehdään tuoreessa keinotekoisessa merivedessä (tai
jopa makeassa vedessä) ei tuloksilla ole
välttämättä mitään käyttöä
arvioitaessa kyseisen aineen tehokkuutta. Eli kun näet
tuotetiedoissa väitteitä aineen metallien sitomiskyvystä,
kannattaa olla skeptinen siihen asti kunnes olet varmistunut
olosuhteista joissa tuotetta on testattu.
Metallien lisääjä: ruuat
Jos haluat
vähentää metallien määrää
akvaariossasi, kannattaa kiinnittää huomiota ruokiin joita
käytät. On tietysti mahdotonta välttää
metallien lisäämistä ruokien mukana kokonaan koska kaikki
merestä lähtöisin olevat ainekset
sisältävät huomattavia määriä erilaisia
metalleja joita eliöt keräsivät itseensä vielä
meressä eläessään. Joitain asiaoita kannattaa
kuitenkin ottaa huomioon ruokia valitessasi.
Kiitos ihmisten huolen omasta
terveydestään, useita ruokia on tutkittu tiettyjen metallien
osalta. Esimerkiksi tiedetään, että mm. simpukat
sisältävät luonnostaan korkeita kupari- ja
sinkkipitoisuuksia. Jotkin kalat ja simpukat voivat myös
sisältää saasteista johtuen epätavallisen paljon
monia metalleja, kuten kuparia, sinkkiä, kadmiumia, elohopeaa ja
lyijyä.
Ihmisten, jotka sairastavat
Wilsonin tautia täytyy syödä ruokia joiden
kuparipitoisuudet ovat alhaisia ja heille tarkoitetusta tiedosta
löytyvät mm. nämä kuparipitoisuudet:
Taulukko 1. Kuparipitoisuuksia eri
eliöissä
|
Ruoka
|
Kuparipitoisuus
(ppm wet)
|
|
Kala
|
0.61
|
|
Kampasimpukat
|
0.27
|
|
Simpukka
|
6.1
|
|
Rapu
|
7.4
|
|
Katka
|
1.8
|
|
Osterit
|
2.9
|
|
Sinisimpukka
|
4.8
|
|
Hummeri
|
37.0
|
Yllä olevasta taulukosta
käy selvästi ilmi, että on mahdollista valikoida
kuparipitoisuudeltaan alhaisia tuotteita. On myös huomattava,
että usein sisälmykset sisältävät huomattavasti
enemmän raskasmetalleja kuin lihaskudos.10
Yhden vuoden aikana näistä kertyy varsin huomattava
määrä raskasmetalleja: jos lisäät joka
päivä 5 grammaa hummeria 380 litran akvaarioon,
lisäät akvaarioon vuodessa 178 ppb kuparia. Jos taas ruokit
vastaavan määrän kampasimpukoita, on
määrä vain 1.3 ppb! Näitä määriä
voidaan verrata Shimekin artikkelista saataviin arvoihin: suolat, joiden
arvioitiin sisältävän runsaasti raskasmetalleja,
sisälsivät n. 100-200 ppb kuparia ja vastaavasti
"vähäkupariset" suolat sisälsivät 1-40 ppb Cu.
Yllä olevasta on helppo päätellä, että
ruoka-aine valinnoilla on suuri vaikutus akvaarion kuparipitoisuuteen.
Useat harrastajat
käyttävät teollisesti valmistettuja ruokia tuoreen ruuan
sijasta. Shimekin ruoka-aine tutkimuksesta saadaan taulukoissa 2 ja 3
esitetyt pitoisuudet. Vaikka missään näissä ruuissa
ei olekaan hummerin kuparipitoisuuksia, pääsee "lancefish"
lähelle ja joka tapauksessa eri ruokien väliset erot ovat
suuria. Alla olevissa taulukoissa olen korostanut erityisen korkeat
pitoisuudet punaisella ja erityisen alhaiset arvot vihreällä.
Huomaa, että jotkut näistä ruuista
sisältävät huomattavan määrän vettä.
Tästä syystä olen lisännyt taulukkoon rivin
kaloria/gramma. Kuten taulukoista on helposti nähtävissä,
"märät" ruuat ovat n. 4-5 kertaa heikompia kuin kuivaruuat
joten niiden eri pitoisuudet tulee kertoa vastaavalla (4-5)
määrällä saadaksesi vertailukelpoisen
metallipitoisuuden.
Jos tarkastelemme
pelkästään metallipitoisuuksia ja jätämme
huomioimatta ravinteellisen koostumuksen, näyttää
"Tahitian Blend" olevan hyvä ratkaisu (Eric Borneman on kuitenkin
todennut, että kyseisen ruuan partikkelikoko on
käyttökelvoton monille organismeille (pers. comm.)).
Mikäli tietäisimme tarkalleen, mikä metalleista on
kaikkein tärkein, valinta saattaisi olla hyvinkin erilainen.
Taulukko 2. Metallipitoisuudet eri
teollisesti valmistetuissa ruuissa (ppm).
|
Metallit
|
Formula One
|
Formula Two
|
Prime Reef
|
Lancefish
|
Artemia
|
Plankton
|
|
Kaloria/gramma
|
0.8
|
0.8
|
0.8
|
0.9
|
0.3
|
0.7
|
|
Alumiini
|
15.00
|
15.00
|
11.00
|
9.80
|
120.00
|
8.10
|
|
Arseeni
|
<0.50
|
<0.46
|
<0.52
|
2.10
|
<0.44
|
<0.42
|
|
Barium
|
0.55
|
0.73
|
0.72
|
<0.025
|
0.72
|
0.63
|
|
Kadmium
|
0.08
|
0.10
|
0.07
|
<0.02
|
<0.02
|
<0.02
|
|
Kromi
|
0.28
|
0.07
|
0.12
|
1.10
|
0.52
|
0.18
|
|
Kobaltti
|
0.10
|
0.10
|
0.12
|
0.11
|
0.11
|
0.07
|
|
Kupari
|
2.30
|
1.80
|
2.00
|
24.00
|
1.30
|
10.00
|
|
Mangaani
|
4.40
|
13.00
|
14.00
|
3.40
|
10.00
|
0.62
|
|
Molybdeeni
|
<0.25
|
<0.23
|
<0.26
|
<0.25
|
0.22
|
<0.21
|
|
Nikkeli
|
<0.25
|
<0.23
|
<0.26
|
<0.25
|
0.32
|
<0.21
|
|
Tina
|
0.72
|
0.70
|
0.70
|
2.40
|
0.34
|
0.38
|
|
Sinkki
|
37.00
|
99.00
|
120.00
|
30.00
|
6.90
|
5.80
|
Taulukko 3. Metallipitoisuudet eri
teollisesti valmistetuissa ruuissa (ppm).
|
Metallit
|
Gold Flakes
|
Tahitian
Blend
|
Saltwater
Staple
|
Nori
|
Golden
Pearls
|
|
Kaloria/gramma
|
4.2
|
2.4
|
3.6
|
3.6
|
3.9
|
|
Alumiini
|
80.00
|
14.00
|
95.00
|
83.00
|
49.00
|
|
Arseeni
|
2.30
|
<0.17
|
2.70
|
25.00
|
3.70
|
|
Barium
|
5.20
|
0.83
|
6.90
|
5.90
|
1.70
|
|
Kadmium
|
<0.84
|
<0.02
|
1.30
|
1.20
|
0.90
|
|
Kromi
|
5.60
|
0.80
|
<0.05
|
1.30
|
1.00
|
|
Kobaltti
|
0.80
|
0.40
|
0.80
|
1.30
|
4.40
|
|
Kupari
|
10.00
|
6.50
|
9.50
|
3.00
|
22.00
|
|
Mangaani
|
23.00
|
18.00
|
90.00
|
110.00
|
49.00
|
|
Molybdeeni
|
1.80
|
0.19
|
0.61
|
<3.30
|
1.20
|
|
Nikkeli
|
1.80
|
0.30
|
0.25
|
<3.30
|
<0.23
|
|
Tina
|
2.50
|
1.40
|
1.40
|
4.80
|
1.10
|
|
Sinkki
|
63.00
|
12.00
|
190.00
|
38.00
|
280.00
|
Metallien lisääjä:
kalkkivesi
Kalkkivesi (kalsiumhydroksidi
tai kalsiumoksidi liuenneena veteen) on mainio kalsiumin ja
alkaliniteetin lähde silloin, kun halutaan välttää
tiettyjä raskasmetalleja. Tämä ei johdu
niinkään käytettyjen aineiden puhtaudesta kuin
siitä, että kalkkivesi on itsestään puhdistuva seos
jos sitä vain käytetään oikein. Esimerkiksi on
tiedetty jo 100 vuotta että kupari ei liukune kalkkiveteen.
USA:n maatalousministeriö totesi vuonna 1908 mm. seuraavaa:
"The solutions obtained by
adding excess of lime to copper sulphate solutions of various
concentrations were found to be free from copper and were alkaline."12
Raportin mukaan sininen
kuparihydroksidi saostuu liuoksesta. Luonnollisesti
mittausmenetelmät ovat kehittyneet huimasti sitten vuoden 1908 ja
vaikka silloiset tutkijat luulivat lioksen olevan täysin
kuparivapaa, sisälsi se varmasti edelleen jonkin verran kuparia.
Mutta kuitenkin paljon vähemmän kuin alkuperäinen
liuos! Siitä asti kalkkia on käytetty useisiin kuparin
poistoon liittyviin sovelluksiin kuten sen poistoon metallien
syövytysliuoksista,13
likavedestä,14 ja
viemäreistä.15 Sitä on
käytetty myös estämään kuparin liukenemista
vesiputkista.16 Kalkin on myös
osoitettu kykenevän saostamaan tinaa,17
ja nikkeliä.18
Miksi kalkkivesi toimii
näin ja miten voimme sitä käyttää?
Korkeassa pH:ssa monet metallit
muodostavat liukenemattomia hydroksideja ja oksideja. Itseasiassa korkea
pH on yleisesti ottaen hyvä tapa saostaa tai rajoittaa monien
metallien liukenevuutta. Mikäli kalkkiveden annetaan rauhassa
asettua ja ainoastaan kirkas liuos annostellaan akvaarioon,
jää sekoitusastian pohjalle kaikki vedestä mahdollisesti
saostuneet metallien hydroksidit. Esimerkiksi kupari saostuu
kuparihydroksidina:
Cu++ + 2OH- à Cu(OH)2 kiinteä
Näin ollen kalkkivesi
todellakin on "itsestään puhdistuva" kunhan vain huolehdimme,
että yhtään muodostuneesta kiinteästä sakasta
ei pääse akvaarioon. Tämän prosessin tehokkuus
riippuu monesta tekijästä, kuten metallista
itsestään, pH:sta ja siitä,
käytetäänkö (ja kuinka paljon) etikkaa
kalkkivedessä. Etikka laskee liuoksen pH:ta ja näin ollen
myös vaikuttaa monien hydroksidien liukenevuuteen - lisäksi
etikka mahdollisesti muodostaa joidenkin metallien kanssa asetaatteja
jotka ovat vesiliukoisia. Jotkin metallit voivat myös muodostaa
epätavallisia yhdisteitä kalkkivedessä. Esimerkiksi
kupari saattaa esiintyä epätavallisena yhdisteenä Cu(OH)3-. Tällöin nimenomaan
tämä yhdiste määrittää kalkkiveden
puhdistustehon puhtaan Cu++:n sijaan.
Seuraavassa tyyppillisen USA:n ravintospeksin täyttävän
kalsiumoksidin analyysi:
Taulukko 4.
Tyypillisen CaO:n analyysi
|
|
Si
|
0.35%
|
|
CaO
|
98.0%
|
|
LOI
|
0.50%
|
|
Magnesium
& Alkali Salts
|
1.0%
|
|
Fluoride
|
75 ppm
|
|
Lead
|
<0.5 ppm
|
|
Arsenic
|
<1.0 ppm
|
|
Acid Insoluble
Substances
|
0.20%
|
|
Heavy Metals
|
2 ppm
|
|
Al
|
0.10%
|
|
Fe
|
0.04%
|
|
S
|
0.01%
|
|
CO2
|
0.40%
|
|
P
|
50 ppm
|
|
Mn
|
12 ppm
|
|
Ca
|
69.97%
|
|
Crystalline
Silica
|
<0.1
|
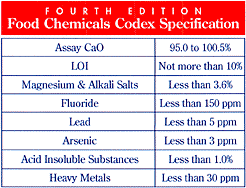
Huomaa, että artikkelin
kirjoittajan käyttämä kalsiumoksidi voi
sisältää 2 ppm raskasmetalleja, 0.1% alumiinia, 12 ppm
mangaania ja alle 0.5 ppm lyijyä. Taulukossa 5 esitetään
kalkkiveden vaikutukset eri metallien määriin akvaariossa,
johon lisätään joka päivä 2% akvaarion
tilavuudesta kalkkivettä:
Taulukko 5. Kalkkiveden
kumulatiivinen vaikutus akvaarion metallipitoisuuksiin jos kaikkien
käytetyn kalsiumoksidin epäpuhtauksien annetaan joutua
akvaarioon:
|
Metallit
|
Lisäys
vuodessa [ppb]
|
|
Kalsium
|
5,956,000
|
|
Alumiini
|
8,300
|
|
Mangaani
|
100
|
|
Raskasmetallit
yhteensä
|
16.7
|
|
Arseeni
|
<8
|
|
Lyijy
|
<4
|
Kaikkein pahinta on, että
ruuaksi kelpaava kalsiumoksidi saa sisältää 15 kertaa
enemmän raskasmetalleja kuin tyypillinen analyysi osoittaa. Toisin
sanoen huimat 250 ppb raskasmetalleja ja 60 ppb lyijyä vuodessa.
Riippuen siitä, mitä itseasiassa näillä
"raskasmetalleilla" tarkoitetaan, saattaa kalsiumoksidin
sisältämät epäpuhtaudet muodostaa huomattavan
ongelman akvaarioissa (keskimääräinen kuparipitoisuus
10-40 ppb, luonnon merivedessä vielä huomattavasti alhaisempi).
Valitettavasti kaikki metallit
eivät saostu kalkkivedessä. Esimerkiksi alumiini muodostaa
tiettyjä yhdisteitä vedessä jotka ovat liukenevia
myös korkeassa pH:ssa. Tulevissa artikkeleissa pyrin joko
kokeellisesti tai sitten kirjallisuusviittein osoittamaan mitkä
meitä kiinnostavista metalleista saostuvat ja miten paljon
kalkkivedessä.
Metallien lisääjä: CaCO3/CO2 Reaktorit
Tarkastelemme, missä
määrin kalsiumreaktorit lisäävät akvaarioveteen
metalleja. Valitettavasti nämä järjestelmät
eivät ole "itsestään puhdistavia" kuten kalkkivesi, joten
lähes kaikki epäpuhtaudet käytetystä CaCO3
materiaalista päätyvät akvaarioon. Epäpuhtaudet
näissä materiaaleissa vaihtelevat tyypin ja valmistajan mukaan
kuten Craig Bingman25 and Greg Hiller26. osoittivat artikkeleissaan. Alla
olevassa taulukossa on esitetty akvaarioon tulevien metallien
määrät, kun reaktoria käytetään
saavuttamaan saman suuruiset kalsium- ja alkaliniteettipitoisuudet kuin
edellisessä kalkkivettä käsittelevässä
kappaleessa. Punaisella merkityt kohdat lisäävät
enemmän kyseistä metallia kuin Instant Ocean suolaseos
(mahdollisesti monet muutkin kohdat tulisi merkitä punaisella,
mutta johtuen analyysimetodeista, niiden todellista
määrää IO:sta ei voida
määrittää).
Taulukko 6. CaCO3/CO2 reaktorin kumulatiivinen vaikutus akvaarion
metallipitoisuuksiin.
|
|
Conklin Limestone
|
Nature's Ocean
|
Koralith
|
Super Calc Gold
|
|
Metalli
|
Lisäys vuodessa
(ppb)
|
Lisäys vuodessa
(ppb)
|
Lisäys vuodessa
(ppb)
|
Lisäys vuodessa
(ppb)
|
|
alumiini
|
<1
|
1246
|
989
|
1060
|
|
arseeni
|
<1.7
|
<1.8
|
54
|
<22
|
|
barium
|
191
|
62
|
0
|
0
|
|
kadmium
|
<0.3
|
0.5
|
<5.0
|
<5.0
|
|
kalsium
|
5956800
|
5956800
|
5956800
|
5956800
|
|
kromi
|
<0.3
|
44
|
<7
|
<7
|
|
kobaltti
|
<0.3
|
1
|
10
|
20
|
|
kupari
|
<1
|
4
|
96
|
88
|
|
rauta
|
153
|
3830
|
0
|
940
|
|
lyijy
|
<1
|
<1
|
119
|
157
|
|
magnesium
|
62409
|
38876
|
14189
|
41785
|
|
mangaani
|
1003
|
207
|
1003
|
1547
|
|
elohopea
|
<1
|
<1
|
26
|
24
|
|
molybdeeni
|
<0.3
|
<0.4
|
<6
|
<6
|
|
nikkeli
|
<0.3
|
4
|
192
|
227
|
|
fosfori
|
904
|
2460
|
81
|
190
|
|
seleeni
|
14
|
19
|
<81
|
<82
|
|
pii
|
150
|
647
|
1125
|
1234
|
|
hopea
|
<0.3
|
<0.4
|
14
|
<3
|
|
strontium
|
4774
|
9447
|
801
|
1492
|
|
rikki
|
99
|
2027
|
28325
|
27210
|
|
tina
|
<17
|
<18
|
<46
|
<47
|
|
titaani
|
4
|
9
|
10
|
5
|
|
vanadiini
|
<0.2
|
62
|
18
|
14
|
|
sinkki
|
<0.2
|
<0.2
|
302
|
244
|
Kuten huomaamme, lisäys
vuoden aikana voi olla huomattava. Erityisesti monet myrkyllisiksi
oletetut metallit (kupari, sinkki, nikkeli, alumiini jne)
lisääntyvät vuoden aikana niin rajusti, että
nollatasosta lähdettäessä ne ovat lopulta "runsaasti"
metalleja sisältävän suolaseoksen (kuten Instant Ocean)
tasolla.
Metallien lisääjä:
tasapainoitetut kalsium- ja alkaliniteettilisäaineet
Useat akvaristit reagoivat hyvin
negatiivisesti kuullessaan, että tasapainoitetut lisäaineet
(kuten B-ionic, C-balance, Kent Tech CD)
sisältävät kuparia ja muita metalleja. B-ionic tuote
esimerkiksi väittää, että se sisältää
kaikkia meriveden sisältämiä aineita oikeissa
mittasuhteissa lukuun ottamatta kalsiumia ja alkaliniteettia. Jotta
tämä väite voisi olla totta, täytyy tuotteen siis
sisältää kuparia sekä muita metalleja. Lisäksi
on huomattava, että mikäli tuote todella
sisältää näitä aineita luonnollisina
pitoisuuksina, niiden määrä ei tule kasvamaan vaan
pikemminkin laskemaan pitkällä aikavälillä.
Useimmat harrastajat
ymmärtävät, että mikäli esimerkiksi
kuparipitoisuus akvaariossa on korkeampi kuin luonnollisessa
merivedessä, voidaan sitä laskea vaihtamalla vanhaa vettä
tuoreeseen meriveteen. Ja jos taas tasapainoitetut tuotteet todellakin
sisältävät vain eri metallien luonnollisia pitoisuuksia,
on niiden käyttö sama kuin tekisi pieniä veden vaihtoja
luonnollisella merivedellä (lukuunottamatta tietysti kalsiumin ja
alkaliniteetin nousua). Epäileville harrastajille:
matemaattinen malli löytyy aiemmasta artikkelistani.
Itse asiassa en ole koskaan
nähnyt riippumatonta tutkimusta yhdestäkään
yllä kuvatun tapaisesta tuotteesta. Toivottavasti pystyn
tulevaisuudessa testaamaan joitakin näistä tuotteista.
Metallien poistaja: makrolevät
On olemassa useita mahdollisia
tapoja poistaa metalleja akvaariosta. Eräs tällaisista on jo
käytössä usealla harrastajalla (vaikkakaan ei ehkä
nimenomaan tätä tarkoitusta silmälläpitäen),
nimittäin makrolevien kasvatus ja keräys. Makrolevien
kyvystä sitoa itseensä raskasmetalleja on olemassa useita
tutkimuksia ja näissä on todettu levien kykenevän
keräämään itseensä huomattavia
määriä metalleja. Taulukossa 7 on esimerkkejä
kirjallisuudessa esiintyvästä numerotiedosta.
Taulukko 7. Lukuja joidenkin
makrolevien sisältämistä metallipitoisuuksista
|
Tutkitut
metallit
|
Tutkitut
levätyypit
|
Pitoisuus (ppm
kuivapainosta)
|
|
Cu, Pb ja Zn
|
26 viher-, rusko ja punalevä lajia27
|
53 ppm asti
|
|
Cd
|
26 viher-, rusko ja punalevä lajia27
|
1.6
|
|
Cr
|
26 viher-, rusko ja punalevä lajia27
|
5.1
|
|
Co
|
26 viher-, rusko ja punalevä lajia27
|
5.9
|
|
Mn
|
Useita viherlevä lajeja28
|
8-120
|
|
Mn
|
Useita ruskolevä lajeja28
|
29-125
|
|
Mn
|
Useita punalevä lajeja28
|
13-160
|
|
Zn
|
Useita viherlevä lajeja28
|
14-36
|
|
Zn
|
Useita ruskolevä lajeja28
|
16-55
|
|
Zn
|
Useita punalevä lajeja28
|
7-33
|
|
Cu
|
Useita viherlevä lajeja28
|
6-8
|
|
Cu
|
Useita ruskolevä lajeja28
|
6-19
|
|
Cu
|
Useita punalevä lajeja28
|
5-29
|
|
Ni
|
Useita viherlevä lajeja28
|
0.6-5
|
|
Ni
|
Useita ruskolevä lajeja28
|
1.4-4
|
|
Ni
|
Useita viherlevä lajeja28
|
1.2-7
|
|
Co
|
Useita ruskolevä lajeja28
|
0.3-3
|
|
Co
|
Useita viherlevä lajeja28
|
0.5-1.3
|
|
Co
|
Useita ruskolevä lajeja28
|
0.4-4
|
|
Zn
|
Yksi Cyanophyta, 9 Rhodophyta, 4 Phaeophyta,
ja 6 Chlorophyta lajia29
|
Jotkut yli 100
ppm
|
|
Cu
|
Yksi Cyanophyta, 9 Rhodophyta, 4 Phaeophyta,
ja 6 Chlorophyta lajia29
|
Jotkut yli 20 ppm
|
|
Pb
|
Yksi Cyanophyta, 9 Rhodophyta, 4 Phaeophyta,
ja 6 Chlorophyta lajia29
|
Jotkut yli 10 ppm
|
Kuten luvuista
nähdään, joidenkin levien sisältämät
metallimäärät ovat huomattavia eivätkä poikkea
kovinkaan paljoa Nori levästä. Luvut ovat myös
samankaltaisia akvaariosta kerättyjen Caulerpa sp. levien pitoisuuksien
kanssa (~12 ppm kuparia, 200 ppm sinkkiä, 10 ppm lyijyä, jne.
kuivapainosta).30 Mikäli
riutta-akvaariosta kerätään suuria määriä
näitä makroleviä, poistuu samalla huomattava
määrä metalleja. Riippuen käytetyistä ruuista
ja makrolevien kasvunopeudesta on mahdollista, että
makrolevillä voidaan poistaajopa enemmän metalleja kuin
ruokien muodossa akvaarioon lisätään !
Metallien poistaja: aktiivihiili
Aktiivihiilen
tiedetään sitovan kuparia makeassa vedessä,31
ja luonnollisesti sen tiedetään myös sitovan orgaanisia
materiaaleja sekä makeassa että merivedessä. On
johdonmukaista ajatella, että koska suurin osa kuparista
akvaariossa on sitoutunut orgaanisiin yhdisteisiin, jotkin
näistä poistuvat akvaariovedestä aktiivihiiltä
käytettäessä. En ole kuitenkaan nähnyt tutkimuksia
tämän tehokkuudesta joten aktiivihiilen rooli metallien
poistajana jää edelleen epätietoisuuden varjoon.
Asiaa on helppo tutkia kuparin
avulla, sillä koska sen tiedetään olevan suurimmaksi
osaksi sitoutunut orgaanisiin aineisiin, edustaa se ideaali tapausta
mitä tulee metallien poistoon aktiivihiilen avulla. Toivon voivani
esittää tällaisen kokeen tulokset
myöhemmässä artikkelissa.
Metallien poistaja: Vaahdotus
Minkään meitä
kiinnostavan metallin epäorgaaniset muodot eivät tartu
ilma/vesi rajapintaan. Itse asiassa tämä rajapinta hylkii
niitä ja tästä johtuen vaahdotus ei
poistaepäorgaanisia esiintymismuotoja.
Kuitenkin ne metallit, jotka
muodostavat sidoksia orgaanisten yhdisteiden kanssa poistuvat em.
yhdisteiden mukana vaahdottimesta. On kuitenkin mahdotonta sanoa, kuinka
tehokas vaahdotin on tässä mielessä. Vaikka alustavat
tutkimukset vaahdokkeesta osoittavatkin sen sisältävän
runsaasti meitä kiinnostavia metalleja, tulee vaahdottimen tehoa
arvioida aina suhteessa akvaarioon sisään tulevien metallien
määrään.
On kuitenkin selvää,
että mitä tehokkaampaa vaahdotus on, sitä
todennäköisemmin metalleja poistuu tämän sovelluksen
avulla. Sen lisäksi, että harrastaja voi hankkia aina
suuremman vaahdottimen, ovat jotkut harrastajat tutkineet mahdollisuutta
lisätä akvaarioon tiettyjä metalleja sitovia orgaanisia
yhdisteitä jotka puolestaan poistuvat vaahdotuksen mukana.
Esimerkiksi useat teolliset polymeerit toimivat tällaisina
aineina. Kuvassa 2 näytetään kuparin sitoutuminen
polyetyylimiiniin. Ongelma tällaisten aineiden
käytössä on se mahdollisuus, että aineet
itsessään olisivat vaarallisia akvaarion organismeille.
Ellemme voi olla varmoja näiden aineiden turvallisuudesta KAIKILLE
akvaarion asukeille, saattaa vaihtokauppa polymeerin ja raskasmetallin
kanssa olla huono.
Kuva 2.
Metallien poistaja: Poly-Filter
Useat harrastajat ovat kuulleet Poly-Bio-Marine:n valmistaman Poly-Filterin
sitovan kuparia ja muita raskasmetalleja. Poly-Filterit koostuvat
orgaanisista polymeereistä jotka on suunniteltu sitomaan laajan
valikoiman kemiallisia yhdisteitä akvaariosta. Aivan kuten kaikkien
metalleja sitovien aineiden kanssa, myös Poly-Filter sitoo
sitä enemmän metalleja mitä enemmän niitä on
vedessä. Valitettavasti juuri tämä tosiasia on
erehdyttänyt monet harrastajat luulemaan, että Poly-Filterit
ovat avuksi kun halutaan vähentää tyypillisen
riutta-akvaarion metallipitoisuuksia (10-40 ppb). Tässä
kappaleessa en puutu siihen, voidaanko tällaisia polymeerejä
valmistaa. Meitä kiinnostaa lähinnä, voidaanko olemassa
olevia Poly-Filtereitä käyttää madaltamaan olemassa
olevia kuparin pitoisuuksia.
Päin vastoin kuin
valmistajat yleensä, Poly-Bio-Marine tarjoaa erinomaista dataa ja tekee vastauksen em.
kysymykseen harvinaisen selväksi. Valitettavasti heidän
mukaansa tuote ei toimi useiden metallien kohdalla keinotekoisessa
merivedessä. Itse asiassa tuote on suunniteltukkin niin, ettei se
vähennä esimerkiksi kuparipitoisuutta alle 30 ppb:hen. Alla
lainauksia valmistajan kotisivulta:
“ASTM Standard D 1141 lists only
six (6) trace elements which are : Barium (99.4 mg/L), Manganese (34.0 mg/L), Copper (30.8 mg/L), Zinc (9.6 mg/L), Lead (6.6 mg/L) and
Silver (0.49 mg/L).”
"Our next section will go into
details of how Poly-Bio-Marine, Inc.'s special manufacturing process
prevents Poly-Filter from sorbing those trace elements and other major
or minor synthetic seasalt components."
"In order to make a Poly-Filter
not capable of sorbing trace elements we must first saturate each
Poly-Filter with the trace elements found in synthetic seawater."
"Upon completion Poly-Filter
will not sorb trace elements nor calcium, magnesium, strontium or
fluoride."
Toisin sanoen he
lisäävät tiettyjä metalleja Poly-Filteriin
valmistuksen aikana välttääkseen niiden "liiallisen"
sitoutumisen akvaariossa. Todellisuudessa en edes tiedä,
pitävätkö heidän väitteensä paikkaansa ja
voidaanko niitä edes soveltaa todellisiin akvaario-olosuhteisiin,
sillä kaikki testit tehtiin joko makeassa vedessä tai sitten
vastavalmistetussa keinotekoisessa merivedessä. Näin on
jäänyt testaamatta todellisessa akvaariossa olevien
orgaanisten aineiden vaikutus tuotteen toimivuuteen. Joka tapauksessa,
vaikka uskoisimmekin valmistajan väitteet, ei Poly-Filter sovellu
akvaariossa kuin sinkin vähentämiseen merkittävissä
määrin.
On täysin mahdollista,
että Poly-Filter on tehokkaampi kuin alla olevasta taulukosta
käy ilmi sillä sen väitetään myös
poistavan orgaanisia aineita. On kuitenkin myös mahdollista,
että tämä ominaisuus ei autakaan ja toivonkin voivani
tulevissa artikkeleissa käsittelemään asiaa tarkemmin
tutkittuani näitä tuotteita todellisissa akvaario-olosuhteissa.
Taulukko 8. Poly-Filter metallien
sitojana
|
Metalli
|
Sitoutumisen
alaraja (ppb)
|
Akvaariossa
esiintyvä pitoisuus (ppb)3
|
|
Barium
|
99
|
5-33
|
|
Mangaani
|
34
|
None Detected (less than
0.5 ppb)
|
|
Kupari
|
31
|
18-38
|
|
Sinkki
|
10
|
190-260 ppb
|
|
Lyijy
|
7
|
None Detected (less than
10 ppb)
|
|
Hopea
|
0.5
|
None Detected (less than
10 ppb)
|
Matallien poistaja: muut
Useita muitakin mahdollisia
metallien poistajia riutta-akvaarioon löytyy. Alla lyhyesti
muutamia.
1. Metallien sitominen
epäorgaanisiin aineisiin kuten kalsiumkarbonaattiin, raudan
oksideihin, alumiiniin ja saveen (esim. kaoliini). Tässä
sovelluksessa em. aineita sijoitetaan jonkinlaiseen suodattimeen, kuten
leijusuodattimeen tai jopaCaCO 3/CO2 reaktoriin ilman hiilidioksidia. Yleisesti
tiedetään useiden näistä aineista sitovan metalleja.33-44 Esimerkiksi rautaoksidia on
käytetty poistamaan kuparia ja lyijyä jätevedestä.33,34 Kuparin sitoutumista on tutkittu
merivedessä sekä ilman että yhdessä orgaanisten
aineiden kanssa.35 Tällaisten
menetelmien teho pitäisi kuitenkin tutkia todellisissa
akvaario-olosuhteissa.
On mielenkiintoista, että
metallien sitoutuminen neitseelliseen kalsiumkarbonaattipintaan (kuten
kasvavaan koralliin) voi hyvinkin olla pääasiallinen metallien
poistumisreitti akvaariossa. Koska tämä ilmiö on
samankaltainen kaikissa riutta-akvaarioissa, voisi se selittää
sen miksi täysin erilaisissa akvaarioissa kuparipitoisuudet ovat
hyvin lähellä toisiaan.2
Tämän poistumisreitin yleisyys on juuri johtanut ajatukseen
sen käyttämistä metallien sitomiseen.
2. Erityisesti metallien
sitomiseen suunniteltujen polymeerien käyttö. Olen itse
patentoinut useita tällaisia aineita lääketieteelliseen
käyttöön ja maailmasta löytyy huikea
määrä vastaavia dokumentoituja sovelluksia.
Käyttökelpoisia ovat sellaiset funktionaaliset orgaaniset
aineet, jotka sitovat voimakkaasti metalleja. Tällaiset materiaalit
muistuttaisivat ja toimisivat samoin kuin Poly-Filter. Itse asiassa
Poly-Filter ilman metallien "alkulatausta" saattaisi olla toimiva
ratkaisu. Jälleen kerran näidenkin tuotteiden todellinen teho
tulee ilmi vasta niitä testattaessa todellisissa
akvaario-olosuhteissa. Joitakin tuotteita on kaupallisesti saatavissa ja
pyrin tulevaisuudessa testaamaan niiden soveltuvuutta
akvaariokäyttöön.
Metallien esiintymismuto
vaikuttaa ratkaisevasti siihin, miten hyvin nämä tuotteet
toimivat. Ne saattavat toimia paljon paremmin tuoreessa keinotekoisessa
merivedessä kuin akvaariovedessä, jossa kelatoituminen
näyttelee suurta roolia. On mahdollista suunnitella polymeeri
siten, että se on tarpeeksi voimakas sitomaan metallin siihen
kiinnittyneestä orgaanisesta yhdisteestä, mutta miten nopeaa
tämä on ja miten paljon prosessia häiritsee kilpailevat
ionit (kuten kalsium ja magnesium) jää
nähtäväksi. Myös hinta on vielä avoin kysymys.
Jotain tämän tapaisia
tuotteita on jo saatavilla, kuten "Toxic Metal Sponge" Kent Marinelta ja
"Cuprisorb" Seachemilta. Näidenkään tuotteiden
toimivuutta ei ole toistaiseksi testattu.
3. Mainitsin aiemmin
tässä artikkelissa, että hyvinkin erilaisissa
akvaarioissa on silmiinpistävän samanlaiset kuparipitoisuudet
(5-40 ppb), riippumatta mm. siitä, käytetäänkö
keinotekoista vai luonnon merivettä. Miten tämä on
mahdollista? Metallien sitoutuminen kalsiumkarbonaattiin on yksi
varmalta kuulostava selitys.
On kuitenkin myös
mahdollista, että kuparipitoisuuden ylärajaa
säätelevät biologiset prosessit. Kuparin
tiedetään sitoutuvan biologisiin pintoihin aina bakteereista
koralleihin. Milleron esittämän graafin mukaan esimerkiksi
bakteerit sitovat kuparia hyvin voimakkaassa suhteessa kuparin
määrään välillä 5-50 ppb.4
Pitoisuuden ollessa 50 ppb sitoutuu bakteereihin kuparia neljä
kertaa enemmän kuin 5 ppb pitoisuudessa. 50 ppb:stä aina 200
ppb:hen asti sitomiskyky ei enää kasva. Toisin sanoen, kun
akvaariossa kuparipitoisuus alkaa nousta välillä 5-50 ppb,
bakteerit tyrehdyttävät nousun tehokkaasti. Vastaavasti kun
pitoisuus laskee samalla välillä, vapautuu bakteereista
kuparia joka jälleen vaimentaa mitattavissa olevaa muutosta. Eli on
mahdollista että bakteerit ja muut biologiset yksiköt toimivat
eräänlaisina "kuparipuskureina" akvaariossa ja
tästä syystä pitoisuudet ovat niin samanlaisia eri
tyyppisissä altaissa.
Vaikkakin on vaikeaa kuvitella
tämän tiedon auttavan vähentämään kuparin
määrää akvaariossa, on selvää että
tällainen biologisesti sidottu kupari voi tehdä sen
vähentämisestä selvästi hankalampaa kuin
pelkästä vesiliuoksesta.
Yhteenveto
Olen tässä
artikkelissa antanut pohjatietoa metallien luonteesta
akvaarioympäristössä voidakseni auttaa akvaristeja
ymmärtämään akvaarioitaan paremmin sekä
mahdollisesti käyttämään toimenpiteitä, joilla
he voivat ylläpitää matalampia metallipitoisuuksia.
Metalleilla on monta
reittiä akvaarioon, mahdollisesti monia joita ei tässä
artikkelissa ole mainittu. On erityisen tärkeää
kiinnittää huomiota käytettyihin ruokiin ja
lisäaineisiin sillä näillä on avainasema kun
pyritään vähentämään metallipitoisuuksia.
Lisäämällä
metallien poistoa akvaariosta voidaan pitää
itsestään selvänä keinona vähentää
metallipitoisuuksia. Jonkinlainen yhdistelmä aktiivihiiltä,
vaahdotusta, erityyppisiä metallinsitoja-aineita ja biologista
poistoa (mm. levät) voidaan lukea tähän kategoriaan.
On todennäköistä,
että sekä sisääntulevien metallien
määrän vähentämistä että poiston
lisäämistä tarvitaan kun halutaan päästä
lähelle luonnon merivedessä esiintyviä
metallipitoisuuksia. Tähän
määränpäähän pääsemistä
saattaa kuitenkin vaikeuttaa huomattavsti se, että osa metalleista
voi olla varastoituneena biologisiin ja epäorgaanisiin
"puskureihin" jolloin tarvitaan hyvinkin rajuja muutoksia jotta
lopullinen taso laskee.
Toivon voivani esittää
arvioita joidenkin tässä artikkelissa mainittujen menetelmien
tehokkuudesta tarkemmin myöhemmissä artikkeleissa.
Sillä välin… Happy
Reefing!
|