|
Introdución
Todos los acuaristas de arrecife están
bien conscientes de qué tan propensos están
a desastres en sus acuarios. Uno de los sabios consejos en
nuestro pasatiempo dice que: "los desastres ocurren rápidamente,
el éxito requiere tiempo y paciencia." De aquí,
el mensaje es claro; cuando las cosas van mal, los problemas
resultantes a menudo ocurren rápidamente. Conscientes
de la naturaleza precaria de nuestros ecositemas artificiales,
la mayoría de los aficionados hacen todo lo que está
a su alcance para asegurar que sus bellas y caras criaturas
no mueran. Muchos aficionados tienen sistemas de emergencia
contra fallas en al energía electrica, fallas en los
equipos, problemas en los niveles de agua e imbalances químicos.
Es irónico y desafortunado que todas estas medidas
de seguridad se vean grandemente amenazadas por el uso de
sal artificial que, debido a su pobre formulación,
pudiera estar envenenado los animales que el aficionado trata
de proteger.
Entre los Biólogos Marinos profesionales,
en particular aquellos que trabajan con embriones de invertebrados,
la mezcla de sales para sal marina artificial promedio ha
sido reconocida por muchos años como un substituto
imperfecto para lo que es el medio perfecto para crecimiento
de animales marinos, agua salada oceánica pura. Esto
aplica en especial para organismos delicados como embriones
(Strathmann, 1987). Los organismos marinos han evolucionado
en agua de mar natural y la selección natural ha hecho
los ajustes finos de su fisiología a este medio. Muchos
de estos organismos no tienen pieles a prueba de agua y el
bienestar de la criatura depende directamente de la solución
que lo rodea. Mientras que hay una tolerancia a variaciones
de la condición "normal" para las que los
animales están preparados, generalmente esa tolerancia
es pequeña y limitada al rango de variación
natural (Prosser, 1991).
El agua de mar no es sólo una solución
de cloruro de sodio y agua, sino es mas bien una mezcla compleja
y no completamente entendida de virtualmente toda sustancia
que ha aparecido en la faz de la tierra. Cualquier cosa que
puede ser lavada río abajo eventualmente halla su camino
a los mares y es incorporada en la solución de los
oceanos (Pilson, 1998). El gran volumen de los océanos
del mundo asegura que la concentración de la solución
de la mayoría de estos materiales sea muy pequeña,
en el rango de partes por billón o menor. Una parte
por billón es una cantidad pequeña y para imaginarse
una fracción tan chica, a veces es necesaria ayuda.
Si suponen que una persona promedio pesa aprox. 75 kilos,
una parte por billon sería el equivalente a una carta
de una onza en el bolsillo de una persona en un grupo de 416,667.
Y sin embargo, los organismos responden a materiales presentes
en concentraciones aún más pequeñas que
una parte por billón.
Al nivel celular básico, toda la
vida depende del funcionamiento correcto de una compleja serie
de reacciones químicas interconectadas. Estas reacciones
son gobernadas y controladas por enzimas (las enzimas son
proteínas N del T) cuyas capacidades se determinan
por el ambiente celular interno. En las criaturas marinas,
el ambiente celular interno depende directamente del agua
de mar en el medio que rodea al organismo. Cambios en la salinidad,
por ejemplo, a menudo son directamente responsables de cambios
en el metabolismo celular. Adicionalmente, los químicos
disuletos en el agua de mar pueden afectar directamente la
función celular. Esto es particularmente cierto para
los iones metálicos en el agua de mar.
Los iones metálicos resultan de
la disolución de alguna sal metálica en el agua
y a menudo son muy importantes en la función de las
enzimas. En cantidades apropiadas, varios iones metálicos
aseguran que las enzimas tengan la forma correcta y realicen
la función adecuada. Sin embargo, cuando se encuentran
en la concentración equivocada, muchos iones metálicos
pueden interferir con y cambiar la estructura de, las enzimas.
Estos cambios generalmente causan serios problemas al organismo.
Por ejemplo, cantidades muy pequeñas de cobre, precisamente
esas cantidades encontradas en el agua de mar natural, son
absolutamente necesarias para el funcionamiento correcto del
pigmento hemocianina (el equivalente a la hemoglonina de
nuestra sangre N del T), en los artrópodos y moluscos.
Sin embargo, un ligero incremento en la cantidad de cobre
que rodea a los organismos resultará en un incremento
similar en el ambiente celular interno, causando la desnaturalización
(pérdida de la estructura N del T) de otras
enzimas, matando a estos mismos organismos.
El cobre no es el único metal que
forma iones que interfieren con el metabolismo celular, de
hecho, esta interferencia es una propiedad general de la mayoría
de los metales, particularmente aquellos que son llamados
"metales pesados." Estos son elementos como el cobre,
mercurio, hierro, plomo, plata, zinc, vanadio, níquel
y varios otros. La letalidad de estos materiales contra toda
la vida, incluyendo la humana, es lo que ha impulsado muchas
de las regulaciones ambientales relacionadas a las descargas
de drenajes en los océanos. Previo a la creación
de pesticidas orgánicos, muchos de los pesticidas en
uso eran simplemente mezclas de sales de cobre, zinc, arsénico,
mercurio y otros "metales traza. " Presentes en
concentraciones muy pequeñas, generalmente aquellas
encontradas en el agua de mar, la mayoría de estos
materiales no son nocivos; sin embargo, en concentraciones
ligéramente elevadas matan organismos. (Vean, por ejemplo,
Alutoin, et al., 2001; Breitburg, et al. 1999; Goh, y Chou,
1992; Heyward, 1988; Negri, y Heyward, 2001; Reichelt-Brushett
y Harrison, 1999).
En el último par de años,
he documentado el nivel anormalmente elevado de metales pesados
hallado en los sistemas de acuario y he especulado que estos
metales están causando algo de la mortalidad o "fragilidad"
de organismos que los aficionados expermientan en sus acuarios
(Shimek, 2002a-e). Muchos metales pesados son añadidos
al acuario contínuamente en las comidas, que son adiciones
necesarias al acuario (Shimek, 2001). Los organismos típicamente
detoxifican los metales pesados, aún en niveles normales,
enlazándolos en forma irreversible a proteínas
en sus cuerpos. Esto resulta en la acumulación de materiales
tóxicos en el animal a lo largo de su vida. Si esos
organismos se usan para preparar comidas para acuario, o se
alimenta directamente a los organismos con ellos, la alimentación
puede trasnferir cantidades altas y significativas de metales
pesados a su sistema.
El viejo lema de los ingenieros del ejército
de "la solución a la contaminación es la
dilución," es válido y natural en lso arrecifes,
la disolución parcial de las comidas, digestión
y excreción resultarán en la diseminación
y consecuente reducción de las cargas de metales traza
potencialmente tóxicas. Sin embargo, en el acuario
a diferencia del arrecife verdadero, no hay ningún
lugar al que se puedan ir los metales pesados. La filtración
y exportación pueden remover algunos de estos materiales,
pero no es un proceso particularmente eficiente(Shimek, 2002e),
en especial considerando que algunos de estos metales pueden
encontrarse en concentraciones excesivamente elevadas.
Sin embargo, mucha de esta concentración
excesivamente elevada, no es resultado de la alimentación
o aún de procesos ridículos y peligrosos como
añadir directamente metales tóxicos al tanque
en la forma de aditivos, sino que son el resultado de la formulación
de las mezclas de sales (Atkinson and Bingman, 1999). Aunque
la toxicidad potencial de tales fórmulas ya ha sido
comentada, no había habido pruebas cuantitativas de
las aguas hechas con las mezclas artificiales para determinar
si eran, por sí mismas, tóxicas a los organismos.
Este artículo reporta la primera de esas pruebas.
Materiales y Metodología
Uno de los métodos comunes para
probar la toxicidad de el agua es el uso de un bioensayo.
Los bioensayos son simplemente pruebas de toxicidad hechas
usando organismos vivos colocados en el agua registrando sus
reacciones. Son parte común de las pruebas de toxicidad
en estudios de agua fresca y salada y lo han sido por varias
décadas. El método que decidí usar es
una variante de los muchos bioensayos con larvas de erizos
que son usados comunmente en pruebas ambientales. Literalmente
cintos de variantes de esta prueba están en uso por
todo el mundo, con los procedimientos de la prueba ajustado
a los animales que se estén manejando y al proyecto.
Simplifiqué esta pruba tanto como fue posible para
evitar procedimientos laboriosos intensivos. Al hacer esto,
sacrifiqué algo de la información que pude haber
obtenido de las pruebas. En lugar de eso, me concentré
en un enfoque simple de "si/no" preguntando:
"¿Tiene el tipo de sal artificial
usado un efecto en el número de larvas que se pueden
desarrollar después de que una cierta cantidad de embriones
es expuesta al medio específico?"
En breve, para esta prueba, coloqué
proximadamente igual número embriones en etapas tempranas
de desarrollo (= huevos fertilizados) en vasos de precipitados
con varios tipos de agua de mar y después de dos días
conté todas las larvas que se habían desarrollado
en cada vaso. El número de larvas hallado en cada una
de las soluciones fue entonces comparado para determinar diferencias
entre las soluciones. Adicionalmente, el número de
larvas de las soluciones de prueba se comparó con el
número hallado en agua de mar natural (control negativo)
y en soluciones de cloruro de cobre, un tóxico conocido
(control positivo).
Probé las siguientes sales: Instant
Ocean (Aquarium Systems, Inc.), Bio-Sea Marinemix (Aqua Craft,
Inc.), Crystal Seas Marinemix - Bioassay Formula (Marine Enterprises
International, Inc.) y Coralife (Energy Savers Unlimited,
Inc.). Instant Ocean y Coralife se compraron a los "Drs.
Foster and Smith." Un paquete sin abrir de Bio-Sea Marine
Mix fue proporcionado por un acuarista. La Crystal Seas Marine
Mix - Bioassay Formula me fue enviada directamente del fabricante.
También probé agua de acuarios de dos aficionados
que me mandaron 4 litros cada uno del agua de sus tanques
para probar. Esa agua se colectó y envió en
contenedores de 4 litros para agua destilada que habían
sido comprados; se desechó el agua destilada y los
contenedores se llenaron con agua de los tanques. Dado que
el agua llegó un tiempo antes de el experimento, se
le congeló hasta justo antes de su uso, que fue cuando
se le fundió y ajustó a temperatura ambiente.
Ambos aficionados preparan el agua de sus tanques con Instant
Ocean. Un aficionado usa agua de ósmosis y el otro
agua de pozo. El agua de mar natural se obtuvo de Catalina
Water Company (1605 Pier D Street, Long Beach, California.
90802).
Un día previo al arribo de los animales
para la prueba, preparé 4 litros de cada una de las
mezclas de sales a ser probadas. Todos los envases usados
en la prueba habían sido lavados con ácido y
bien enjuagados en agua destilada, dejándolos secar
al aire. Las sales se mezlcaron a una gravedad específica
de 1.024 a 24°C para igualarlas al agua de mar. Estas
medidas fueron hechas con un higrómetro con una temperatura
de referencia de 15.55°C y ajustado para compensar la
diferencia entre la temperatura de calibración y la
temperatura ambiente. La información acerca de la calibración
de higrómetros y su uso está disponible en linea
en varias direcciones.
Para cada solución a probarse, hice
11 replicados. 10 replicados fueron empleados en la prueba
y no se les tocó durante la prueba una vez que ésta
fue iniciada; el otró se usó para observar el
desarrollo durante la prueba, si yo creía que era necesario.
Cada replicado consistió de 150 ml de la solución
en un vaso de precipitado Tri-Stir sin usar. Durante la prueba,
los vasos fueron cubiertos con una caja petri de plástico
para prevenir la contaminación o evaporación.
No se aplicó ni agitación ni aireación.
Todos los vasos fueron marcados para indicar la solución
que contenían y se les distribuyó aleatoriamente
sobre una mesa de mi oficina/laboratorio. Las pruebas se hicieron
a temp. ambiente. Esta varió de 22 a 27°C durante
el desarrollo del estudio. Estos es un poco más caliente
que lo óptimo, pero dentro del rango acepptable para
esta especie.
Los animales de prueba fueron Arbacia
punctulata, erizos de mar hallados a lo largo de la costa
este de EU. Compré 12 erizos de Gulf Specimen Aquarium
and Marine Supply, Post Office Box 237, Panacea, FL 32346.
Me fueron enviados y se les usó en cuanto llegaron.
Los desempaqué y coloqué en un acuario pequeño
lleno con agua de mar natural a temp. ambiente. La reproducción
se indujo de la manera tradicional, mediante inyección
de dos mililitros de cloruro de potasio 0.53M (molar, N
del T) a través de la membrana peristomial en el
celoma perivisceral. La reproducción se inició
inmediatamente en la mayoría de los animales.
Para más información acerca
de Arbacia punctulata y su embriología sigan
este link: http://database.mbl.edu/Costello/find.taf?function=BB&ID=78
|
|
Figura
1. Macho de Arbacia punctulata en reproducción.
El animal está boca arriba sobre el vaso de precipitados.
Los poros genitales se encuentran en la superficie aboral,
por lo tanto, viendo hacia abajo.Periodicamente, enjuago
el esperma que colecto del erizo en el agua. Los huevos
naranjas obtenidos previamente de una hembra son visibles
en el vaso de la izquierda. Los vaoss experimentales
cubiertos con cajas de Petri se ven al fondo.
|
Los huevos se colectan invirtiendo a los
erizos sobre los vasos llenos de agua de mar natural. El esperma
se colectó enjuagando el esperma de la superficie aboral
con ayuda de una pipeta en vasos llenos de agua de mar natural.
De los 12 A. punctulata inyectados, 8 fueron machos,
2 hembras y 2 no liberaron gametos. Después de que
se completó la liberación de gametos, los huevos
fueron lavados mediante agitación, permitiéndoles
sedimentar y decantando muy cuidadosamente el agua. Agua de
mar natural fresca se agregó y el proceso de lavado
se repitió 3 veces. Las suspensiones de esperma se
juntaron, se les agitó vigorosamente y una dilución
de 1:200 de esperma se mezcló en un vaso nuevo.
Los huevos se examinaron microscópicamente
para asegurarse que estaban maduros por la ausencia de una
vescícula germinal y forma uniforme. El esperma se
analizó microscópicamente para asegurarse de
su motilidad. Un mililitro de la suspensión de esperma
se agregó al vaso con los huevos y la solución
se mezcló completamente con una pipeta. Se colectaron
muestras y se les examinó microscópicamente
para asegurar que la mezcla fue fertilizada. Una vez que se
notó fertilización, aproximadamente un mililitro
de la suspensión de huevos fertilizados se pipeteó
en cada uno de los replicados (con lo que cada replicado tenía
entre 50-80 huevos fertilizados).
|
|
|
Figura
2. Ovulo de Arbacia punctulata previo a la
fertilización.
|
Esta especie se desarrolla rápidamente
a las temperaturas usadas en este estudio y después
de 48 hrs. la larva ha alcanzado el estadio de pluteus temprano.
Este es el primer estadio de alimentación, y dado que
no quería complicar las pruebas alimentando los animales,
la prueba terminaba en esta etapa. El contenido de los vasos
se examinaba bajo una amplificación de 40x y todas
las plutei u otras formas larvarias eran contadas y registradas.
Esto se hizo para todos los 10 replicados. Generalmente, en
esta etapa, las soluciones y las larvas se desecharon.
|
Figura
3. El desarrollo ocurre rápidamente, la etapa
de dos células (izq.) y la de 4 (centro)
se alcanzaron una hora después de la fertilización.
La etapa de prisma (der.) estaba presente un
día después de la fertilización.
La prisma es móvil y nada en el cultivo, pero
los intestinos no se han desarrollado y no se puede
alimentar.
|
|
Figura
4. La larva pluteus temprana de Arbacia punctulata.
Izq.: La larva en la etapa donde la prueba fue
terminada. Bastones de esqueleto interno son visibles
en forma de las células pigmentadas rojas. La
larva es de forma piramidal con el ápice hacia
la derecha. Aunque tiene intestino, no es visible en
esta imagen. Estas larvas se mueven con los dos brazos
largos indicando el camino conforme se alimentan de
algas. Der.: Una larva ligéramente más
vieja que se ha alimentado del alga unicelular Chlorella.
El intestino es visible lleno con las células
verdes del alga.
|
Análisis estadístico:
Los resultados de las pruebas fueron tabulados
y un análisis de varianza (ANOVA) fue realizado. Las
varianzas resultantes del ANOVA requirieron pruebas t subsecuentes
para las diferencias de los promedios de las muestras bajo
la hipótesis de que las muestras tenían varianzas
diferentes. Estas pruebas t se hicieron comparando el número
de embriones en cada grupo experimental (las cuatro mezclas
de sales y los dos tanques de aficionados) contra el número
de embriones hallado en agua de mar natural. Todas las pruebas
estadísticas fueron hechas con la sección analítica
del paquete de hoja de cálculo de Corel Quattro Pro
8.
Resultados:
El número de larvas que se halló
después de 48 hrs. varió ampliamente (Tabla1).
Las muestras del agua de mar artificial hecha con IO contenían
en promedio 4.0 larvas por replicado, mientras que aquellas
con coralife promediaron 7.4 larvas por vaso. La muestra del
aficionado 2 también contenía un bajo número
de larvas, 5.1 vaso. El número de larvas promedio de
las muestras con agua de mar natural, Crystal Sea Marinemix-Bioassay
Formula y BioSea Marinemix tuvieron un promedio más
grande de larvas, variando entre 35.8 a 41.5 larvas por replicado.
No había larvas en el agua de mar natural que tenía
cloruro de cobre donde la concentración de cloruro
de cobre era de 100 ppb o mayor.
|
Tabla 1.
Número de larvas (pluteus tempranas) de Arbacia
punctulata halladas después de 48 hrs.
La solución de cloruro de cobre es usada como
control "positivo", para mostrar que los
embriones serán matados por agentes químicos
de concentración conocida.
|
Natural Aficionado Cloruro
de cobre
|
|
Salt
Mix:
|
Agua de
mar
|
Instant
Ocean
|
Marinemix
Bioassay
|
Coralife
|
Bio-Sea
Marinemix
|
|
A
|
B
|
Larva
|
Concentración
de Cobre en Ppb
|
|
Replicado
|
|
|
|
|
|
|
|
|
|
|
|
1
|
54
|
7
|
36
|
13
|
45
|
43
|
13
|
24
|
0.1
|
|
|
2
|
39
|
4
|
28
|
5
|
13
|
25
|
1
|
37
|
1
|
|
|
3
|
21
|
2
|
39
|
10
|
25
|
9
|
2
|
3
|
10
|
=
0.01ppm
|
|
4
|
23
|
3
|
22
|
0
|
13
|
30
|
10
|
0
|
100
|
=
0.1ppm
|
|
5
|
42
|
8
|
49
|
4
|
32
|
27
|
7
|
0
|
1000
|
=
1.0 ppm
|
|
6
|
41
|
2
|
56
|
0
|
57
|
28
|
5
|
0
|
10000
|
=
10 ppm
|
|
7
|
62
|
5
|
46
|
8
|
49
|
16
|
0
|
0
|
100000
|
=
100 ppm
|
|
8
|
43
|
3
|
50
|
5
|
49
|
30
|
4
|
0
|
1000000
|
=
1.0 ppt
|
|
9
|
17
|
6
|
38
|
13
|
28
|
19
|
6
|
0
|
10000000
|
=10
ppt
|
|
10
|
29
|
0
|
51
|
16
|
47
|
22
|
3
|
0
|
100000000
|
=100
ppt
|
|
Promedio
|
37.10
|
4.00
|
41.50
|
7.40
|
35.80
|
24.90
|
5.10
|
|
|
|
|
Desv.
Std
|
14.57
|
2.49
|
10.86
|
5.54
|
15.77
|
9.24
|
4.07
|
|
|
|
El ANOVA indica que la probabilidad de
que todas las muestras tuvieran la misma varianza es extremadamente
pequeña: P = 9.306 x 10-16 o aproximadamente, uno en
10,000,000,000,000 (Tabla 2).
 |
|
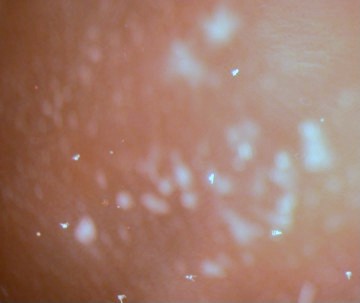
Figura
5. Larvas de Arbacia pluteus en el cultivo
vistas con bajo aumento. Las larvas son las estructuras
blancas con forma de flecha.
|
|
Tabla 2.
ANOVA; Número de replicados = 10
|
|
Resumen
Número de Plutei
|
|
Groupos
|
Sum
|
Promedio
|
Varianza
|
|
|
|
NSW
|
371
|
37.1
|
212.322
|
|
|
|
Instant Ocean
|
40
|
4.0
|
6.222
|
|
|
|
Marinemix Bioassay Formula
|
415
|
41.5
|
117.833
|
|
|
|
Coralife
|
74
|
7.4
|
30.711
|
|
|
|
Bio-Sea Marinemix
|
358
|
35.8
|
248.845
|
|
|
|
Aficionado A (Instant Ocean y agua RO/DI)
|
249
|
24.9
|
85.433
|
|
|
|
Aficionado B (Instant Ocean y agua de pozo)
|
51
|
5.1
|
16.544
|
|
|
|
Análisis
de Varianza
|
|
Fuente de Variación
|
Suma
de cuadrados
|
df
|
media
de cuadrados
|
F
|
Valor
de P
|
Valor
crítico de F
|
|
Entre Groupos
|
36291.485
|
6
|
6048.581
|
27.219
|
9.306x10-16
|
2.246
|
|
Intra Groupos
|
14000.000
|
63
|
222.222
|
|
|
|
|
Total
|
50291.485
|
69
|
|
|
|
|
El número de larvas promedio o la
media de cada muestra experimental se comparó contra
la media de la muestra control con agua de mar natural usando
la prueba t (Tabla 3). Se puede ver que el resultado de las
muestras del agua preparada con IO y Coralife, así
como las muestras del agua del aficionado B, cada una tiene
probabilidades entre 0.00003 y 0.00006 (ó entre 3 y
6 en 100,000) de ser iguales al agua de mar. Por el contrario,
los resultados con Crystal Sea Marinemix Bioassay Formula
y Bio-Sea Marinemix tienen un 45 y un 85% de probabilidad
respectivamente de estar en el mismo grupo de resultados del
agua de mar natural. Generalmente, los Biólogos dicen
que muestras que son diferentes por más del 5% (o dicho
de otra manera, aquellas que tienen menos de 1 oportunidad
en 20 de ser obtenidas de la misma población) presentan
diferencias estadísticas significativas.
Así que, el número promedio
de larvas que se desarrollaron en las muestras hechas con
IO y Coralife fue estadísticamente diferente, y mucho
menor, que el número que se desarrolló en el
agua de mar natural. Por otra parte, el número promedio
hallado en mezclas de Crystal Sea Marinemix Bioassay Formula
y Bio-Sea Marinemix no fue significativamente diferente del
hallado en agua de mar natural.
El número de larvas hallado en las
aguas de ambos aficionados fue significativamente diferente
del número promedio hallado en el agua de mar natural.
Sin embargo, al menos en el caso del aficionado A, el número
de larvas promedio fue relativamente cercano al número
en agua de mar natural.
|
Tabla
3. Probabilidad de "dos extremos" de
que el número promedio de larvas de las muestras
probadas y el de agua de mar natural fueran obtenidos
de la misma población. Determinado mediante una
prueba t suponiendo varianzas diferentes.
|
|
Muestra probada
|
Probabilidad que las
muestras fuesen del grupo que incluía agua de
mar natural.
|
|
Instant Ocean
|
0.00003
|
|
Coralife
|
0.00006
|
|
Marinemix Bioassay Formula
|
0.45432
|
|
Bio-Sea Marinemix
|
0.85033
|
|
Water From Aficionado
A
|
0.04099
|
|
Water From Aficionado
B
|
0.00005
|
Discusión:
Estos datos son correctos y bastante preocupantes.
Muestran que el agua obtenida con algunas sales artificiales
es significativamente más tóxica para embriones
de erizo en desarrollo, y por inferencia hacia otros organismos,
que el agua hecha con sales de otros fabricantes. Sería
más aceptable, creo, si todas las sales fuesen igualmente
tóxicas. Eso indicaría que ningún fabricante
se ha imaginado cómo hacer una mezcla de sales decente
y si ese fuera el caso, los aficionados sólo tendrían
que aprender a vivir con ello. O aprenderían cuáles
especies de animales de arrecife son mas tolerantes de tal
abuso y pueden sobrevivir en ellas. Sin embargo, ésa
no es la situación. La situación es que las
aguas hechas con algunas de las sales probadas son menos dañinas
y tienen mejor sobrevivencia de larvas de erizo que otras.
Al menos las aguas con pobre sobrevivencia de larvas todavia
tienen algo de sobrevivencia, pero comparando contra
el número de embriones que sobrevive en otras aguas,
la mortalidad de los embriones de erizo en agua hecha con
IO es de aprox. 90% y en agua hecha con Coralife es de 80%.
La respuesta animal a las toxinas es una función biológica
y está distribuida en una función estadística
"normal", así que las larvas vistas en las
aguas de estas dos sales son las mas resistentes de entre
las resistentes. Es altamente probable que los efectos de
mortalidad no se limiten a las larvas y estén más
ampliamente expandidos por el pasatiempo de los acuarios de
arrecife. No hay una razón en particular para suponer
que los acuarios de arrecife son más benignos que las
áreas naturales donde bioensayos similares y otras
pruebas como análisis químicos, han mostrado
que otros materiales tóxicos están presentes.
 |
|
Figure
6 . Una pluteus de Arbacia punctulata de
2 semanas. Mantuve unas cuantas larvas vivas en las
mezclas Bio-Sea Marinemix y la Crystal Sea Marinemix
Bioassay Formula alimentándolas con fitoplanckton,
que es visible en el centro del animal como una mancha
verde. Los brazos extra en la parte superior del animal
ayudan en la alimentación y locomoción;
en esta etapa el animal es de 1 mm de largo. (Click
para una imagen mayor).
|
Por supuesto que, siempre es posible que
estos datos estén mal, variaciones aleatorias en el
bien ordenado universo que constituye el pasatiempo de loa
acuarios arrecife. Sería útil si hubiera algún
factor potencial definido que pudiera ser la causa de tal
mortalidad. Bueno, no es de extrañar que lo hay. Las
mezclas de sales artificiales han sido analizadas químicamente
y algunos de sus constituyentes metálicos tienen niveles
aberrantemente elevados (Tabla 4) comparados con el agua de
mar natural. Desafortunadamente, fuí incapaz de análizar
todas las sales por mí mismo en este estudio, pero
algunos datos comparativos independientes están disponibles,
particularmente para las dos sales con la sobrevivencia más
baja. Estas sales fueron análizadas en detalle para
el artículo de Atkinson y Bingman de 1999. Los constituyentes
de las otras sales no fueron analizados independientemente,
y tengo que confiar en los datos proporcionados por el fabricante
de Crystal Sea Marinemix Bioassay Formula. Para Bio-Sea Marinemix,
usé los datos de uno de los folletos de propaganda
describiendo la sal. Afortunadamente, no hay razón
a priori para dudar de la veracidad de estas dos fuentes.
No obstante, la disparidad de las fuentes de los datos de
la Tabla 4 hace imposibles las comparaciones, y otros son
significativamente menos ordenados de lo que hubieran estado.
Sin embargo, así es la vida...
|
Tabla
4. Constituyentes de las mezclas de sales examinadas
en ppm. Los datos para IO y Coralife son de Atkinson
y Bingman, 1999. los datos de Marinemix-Bioassay Formula
fueron proporcionados por el fabricante. Los datos para
Bio-Sea Marinemix son el promedio de dos muestras en
la literatura de propaganda del fabricante. Los valores
para el agua de mar son de Pilson, 1998.t = valores
menores o equivalentes a los de la tabla.
|
|
|
Bio-Sea
Marinemix
|
Instant
Ocean
|
Coralife
|
Marinemix
Bioassay
|
Agua
de mar Natural
|
|
Aluminiou
|
0.20
t
|
6.48
|
7.28
|
0.17
|
0.000270
|
|
Bario
|
No
data
|
0.012
|
0.051
|
0.050
|
0.014
|
|
Cadmio
|
0.003
t
|
0.027
|
0.034
|
0.000
|
0.000079
|
|
Calcio
|
430
|
361
|
405
|
410
|
412
|
|
Chromio
|
0.030
t
|
0.390
|
0.504
|
0.001
|
0.000208
|
|
Cobalto
|
0.030
t
|
0.077
|
0.100
|
0.000
|
0.000001
|
|
Hierro
|
0.040
|
0.114
|
0.178
|
0.001
|
0.000254
|
|
Plomo
|
0.132
|
0.013
|
0.017
|
0.010
|
0.000056
|
|
Litio
|
0.040
t
|
0.435
|
0.601
|
0.004
|
0.000002
|
|
Lithium
|
3.130
|
0.375
|
12.442
|
0.110
|
0.173
|
|
Magnesio
|
1336
|
1264
|
1531
|
1290
|
1284
|
|
Manganeso
|
0.012
|
0.066
|
0.049
|
0.001
|
0.000027
|
|
Molibdeno
|
0.073
|
0.173
|
0.259
|
0.010
|
0.010
|
|
Níquel
|
0.020
t
|
0.100
|
0.129
|
0.000
|
0.000470
|
|
Potasio
|
379
|
367
|
363
|
380
|
402
|
|
Plata
|
0.030
t
|
0.248
|
0.410
|
0.003
|
0.0000027
|
|
Sodio
|
10252
|
10621
|
10667
|
10400
|
10781
|
|
Estroncio
|
9.75
|
16.65
|
7.01
|
12.50
|
7.94
|
|
Titanio
|
No
data
|
0.032
|
0.046
|
0.000
|
0.000010
|
|
Vanadio
|
No
data
|
0.148
|
0.194
|
0.002
|
0.002
|
|
Zinc
|
0.012
|
0.033
|
0.059
|
0.014
|
0.000392
|
La concentración dada en la Tabla
4 para las concentraciones relativas de la mayoría
de los metales traza, que están en partes por millón,
parecen muy bajas y ciertamente parece como que debieran ser
aceptables para el crecimeinto de los animales marinos. Así
es, hasta que se les compara con los valores promedio de algunos
de estos materiales en el agua de mar natural. Si los valores
tabulados de las concentraciones en las mezclas de sales son
divididos entre los valores hallados en el agua de mar natural,
los datos adquieren una "aceptabilidad" muy diferente
(Tabla 5). Los datos en la Tabla 5 están redondeados
al valor entero más cercano y se puede ver que para
los elementos tóxicos conocidos Cadmio, Cobre, Plomo,
Níquel, Vanadio y Zinc, las concentraciones de estos
elementos en IO son 342, 450, 210000, 213, 97 y 83 veces respectivamente,
el valor normal del agua de mar natural. Valores similares
son hallados para Coralife. Es interesante que, para Crystal
Sea Marinemix Bioassay Formulation los valores son 1, 4, 1930,
0, 1 y 36 veces los de los niveles naturales. Mientras que
IO y Coralife tienen 450 y 700 veces la concentración
de cobre hallada en el agua natural en la Crystal Sea Marinemix
Bioassay sólo es 4 veces. Las dos sales con la menor
tasa de sobrevivencia para las larvas tienen consistentemente
concentraciones de metales pesados de cientos o cientos de
miles de veces mayores que la hallada en el agua de mar natural.
Aquellas sales con mejor sobrevivencia tienen concentraciones
de metales pesados que son en el peor de los casos, un tercio
de, y en el mejor, una milésima de esos valores.
En otras palabras, hay sales que se
fabrican que son significativamente mejores permitiendo la
sobrevivencia de los organismos y éstas tienen significativamente
menores concentraciones de metales pesados tóxicos
llamados eufemísticamente en la propaganda literaria
de los acuarios de arrecife como "metales traza benéficos."
El patrón de sobrevivencia de las
larvas en los controles positivos o aquellos en el agua de
mar natural dosificada con cloruro de cobre, indican una falla
significativa en el desarrollo de las larvas, presumiblemente
causada por el cobre, a concentraciones de cobre entre 1-10
ppb. El número de larvas hallado en las soluciones
de cobre de 1 ppb o menos, que casi corresponde a los niveles
en el agua de mar natural (de alrededor de 0.2 ppb), están
en el rango de valores hallado en las muestras control de
agua de mar natural. A 10 ppb, el número de larvas
en los controles dosificados con cobre es casi equivalente
al número de larvas hallado en IO y Coralife. Ambas
mezclas contienen concentraciones de cobre significativamente
elevadas (y en general concentraciones mucho mayores de metales
pesados), sin embargo, que lo que hay en el vaso control positivo
dosificado con cobre (Tabla 4). Adicionalmente, las concentraciones
de metales halladas en el agua hecha con las mezclas de sales
es mucho mayor de la que se ha demostrado en otros estudios
que causa aún más mortalidad y efectos deletéreos
que los vistos en el presente estudio(Vean por ejemplo, Alutoin,
et al., 2001; Breitburg, et al. 1999; Goh, y Chou, 1992; Heyward,
1988; Negri, y Heyward, 2001; Reichelt-Brushett y Harrison,
1999). Que algunas larvas se hallan encontrado en este estudio
indica que alguna detoxificación está ocurriendo.
Esto puede deberse a un número de factores, incluyendo:
algún químico como agente quelante, añadido
a la mezcla de sales: algún tipo de interacción
competitiva entre los agentes químicos presentes en
exceso o algún factor extrínseco, como bacterias
o metabolitos de los erizos de mar, introducidos en los vasos
durante el experimento. Aún cuando el agua de mar hecha
con las mezclas es tóxica, es menos tóxica de
lo que debería ser. En este caso, el todo es menor
a la suma de sus partes.
|
Tabla 5.
La concentración de varios constituyentes d elas
mezclas de sales como una fracción de la concentracón
en el AMN. Los valores se redonderon al entero más
cercano. ND = No datos.
|
|
|
Instant
Ocean
|
Coralife
|
Marinemix
Bioassay Formulation
|
Bio-Sea
Marinemix
|
|
Alumino
|
24000
|
27000
|
630
|
741
|
|
Bario
|
1
|
4
|
3
|
ND
|
|
Cadmio
|
342
|
428
|
1
|
38
|
|
Calcio
|
1
|
1
|
1
|
1
|
|
Cromio
|
1875
|
2425
|
2
|
144
|
|
Cobalto
|
65000
|
85000
|
85
|
25452
|
|
Cobre
|
450
|
700
|
4
|
157
|
|
Hierro
|
240
|
300
|
179
|
2363
|
|
Plomo
|
210000
|
290000
|
1930
|
19305
|
|
Litio
|
2
|
72
|
1
|
18
|
|
Magnesio
|
1
|
1
|
1
|
1
|
|
Manganeso
|
2400
|
1800
|
36
|
418
|
|
Molibdeno
|
18
|
27
|
1
|
8
|
|
Níquel
|
213
|
275
|
0
|
43
|
|
Potasio
|
1
|
1
|
1
|
1
|
|
Plata
|
92000
|
152000
|
1112
|
11124
|
|
Sodio
|
1
|
1
|
1
|
1
|
|
Estroncio
|
2
|
1
|
2
|
1
|
|
Titanio
|
3350
|
4850
|
0
|
ND
|
|
Vanadio
|
97
|
127
|
1
|
ND
|
|
Zinc
|
83
|
150
|
36
|
29
|
Ha habido algo de discusión en la
internet, y otros lados, acerca de cómo, o si, estos
metales tóxicos son detoxificados en nuestros acuarios.
Las propuestas van desde detoxificación por enlace
a ácidos húmicos y minerales de sulfato a enlace
con hidróxidos de hierro. Todos ellos pueden tener
alguna validez en el tanque. Sin embargo, también podrían
no tenerla. El agua del aficionado B fue efectivamente tan
tóxica como el agua recién preparada con las
dos sales menos adecuadas. Con químicos potencialmente
tóxicos siendo hallados en niveles de decenas a miles
de veces más elevados que en la situación natural,
hay ciertamente suficientes materiales tóxicos para
probar. Es bastante posible, y quizá probable, que
algunos elementos tóxicos como el plomo, sean preferencialmente
enlazados a algunos materiales y removidos rápidamente
de la solución, mientras que otros elementos no son
tan fácilmente removidos. La poción de brujo
resultante podría variar de un "chef" de
acuario a otro. Algunos tanques pudieran llegar a ser mucho
más tóxicos que otros, y la diferencia entre
los dos podría deberse a algo tan trivial como una
cepa particular de cianobacteria en un tanque, pero no en
el otro. Esta alga pudiera generar un subproducto que enlaza
y detoxifica cierto metal en ese tanque y por supuesto, el
otro tanque experimentaría más efectos tóxicos.
Adicionalmente, mientras este estudio indica
toxicidad aguda específicamente de dos mezclas de sales,
todavía existe la posibilidad de una mortalidad crónica
o a largo plazo debida a un químico presente en sobreabundancia
en las mezclas de sales "buenas". Esta es una preocupación
especialmente con Bio-Sea Marinemix. Aunque esta sal tiene
niveles mucho menores para la mayoria de los metales hallados
en IO y Coralife, los niveles de algunos materiales en la
mezcla, particularmente pomo, plata, cobalto y litio son todavía
suficientemente altos como para preocupar. Adicionalmente,
yo no tengo buenos valores analíticos para algunos
de los químicos como para estar seguro de sus niveles
(Tabla 4). No obstante, esta mezcla de sal produjo agua con
buena sobrevivencia larval. Todos estos materiales pueden
causar problemas a largo plazo, tales efectos crónicos
no de evaluaron en mi estudio a corto plazo. Adicionalmente,
la toxicidad relativa de otras marcas de sales debe analizarse.
Dada la gravedad potencial de este estudio, sería mejor
asumir lo peor, en vez de asumir que son benignas.
El que los tanques de dos aficionados difieran
uno de otro así como del agua producida por la mezcla
de sal artificial con la que empezaron es evidente al comparar
los datos de IO con los de los aficionados, ambos usaron IO
en sus sistemas. El agua del tanque del aficionado B fue esencialmente
tan letal para las larvas de erizo en desarrollo como el agua
recién preparada con IO. Por otro lado, el agua del
tanque del aficionado A, si bien no es tan buena como el agua
de mar natural o la de las mejores mezclas, fue ciertamente
mucho mejor para los animales en el sistema que el agua recién
preparada con IO. Algunas o todas las diferencias podrían
deberse a algún artefacto del procedimiento experimental.
El congelar el agua de los aficionados pudo haber cambiado
la composición química. Conforme el agua se
congela, los iones no se incoorporan y la concentración
de sales se hace mayor. Muchos de los precipitados regresarán
a la solución al calentarse, pero algunos no, especialmente
el carbonato de calcio y cualquier cosa que coprecipite con
él (quizá incluyendo al cobre). Es imposible
predecir, si esto pudiera hacer al agua más o menos
tóxica, pero es una complicación potencial (R.
Holmes-Farley, com. pers.).
Si el agua tóxica de algunas mezclas
es detoxificada en el acuario después de agregarse
al sistema, hay algunas implicaciones profundas para los cambios
de agua. Esto significaría que con cada cambio de agua,
una masa de agua potencialmente tóxica está
siendo añadida al sistema. Esta agua pudiera ser detoxificada
con el tiempo en el acuario. Aún si esta agua es parcial
o completamente detoxificada en el sistema, tal detoxificación
tomará tiempo y durante ese periodo, los organismos
en el tanque estarán sujetos a concentraciones significativamente
mayores de metales pesados que a las que han estado expuestos
previo a la adición de agua recién mezclada.
Los organismos adultos a menudo pueden
detoxificar estos venenos más eficientemente y más
efectivamente que las larvas usadas en estos experimentos.
No obstante, la contaminación y envenenamiento por
metales pesados es acumulativa; suficiente exposición
a los materiales tóxicos matará a los organismos,
pero podría tomar años. Cambios de agua frecuentes
pueden ser deseables para remover remover otras cosas, quizá
toxinas orgánicas o nutrientes que se acumulan en el
acuario, pero si el agua que se añade está llena
de metales potencialmente venenosos, cada cambio de agua probablemente
resultará en el envenenamiento parcial y acumulativo
de los organismos presentes en el tanque.
Conclusiones:
Este estudio ha demostrado usando una variante
de un bioensayo estándar que el agua de mar artificial
hecha con algunas mezclas artificiales de sal comunmente comercializadas
es tóxica para larvas de erizos. Dicha agua muy probablemente
tendrá efectos en otros animales. Este estudio también
ha mostrado que el agua de mar artificial preparada con algunas
mezclas de sales puede soportar el desarrollo larvario como
lo hace el agua de mar natural. El uso de esa agua de mar
artificial "buena" promoverá la salud de
los organismos del arrecife de coral. Acoplado a un vigoroso
programa de exportación de nutrientes y metales traza
(ver Shimek, 2002e), el uso de dichas sales puede prevenir
la acumulación de metales traza tóxicos en los
tanques de arrecife.
Las dos sales que tienen buena sobrevivencia
larvaria están disponibles a precios razonables. La
Crystal Sea Marinemix-Bioassay Formulation no está
comunmente disponible para los aficionados, ya que está
designada y comercializada para laboratorios de bioensayos.
Sin embargo, está disponible on-line con varios comerciantes.
La Crystal Sea Marinemix - Bioassay Formulation es esencialmente
la misma que la Crystal Sea Marinemix de la que se distingue
por carecer del declorinador que se encuentra en ésta
última (R. Spellman, com. pers.). Las sales Crystal
Sea Marinemix y la Bio-Sea Marinemix están disponibles.
Acknowledgements:
Agradezco a Skip Attix, Eric Borneman y
al Dr. Randy Holmes-Farley por sus revisiones y útiles
comentarios acerca de este artículo. Agradezco al Sr.
Dennis Tagrin de DT's Phytoplankton por sugerirme probar la
fórmula de sales para bioensayos y agradezco al Sr.
Robert Spellman de Marine Enterprises International, por proporcionarme
la sal Crystal Sea Marinemix - Bioassay Formulation y la información
analítica acerca de ella. También estoy en deuda
con el Sr. Lewis J. Wright de la Catalina Water Company quien
me proporcionó el agua de mar empleada en el estudio.
El Sr. Brian Wightman me proporcionó la Bio-Sea Marinemix.
El Sr. Bill Chamberlain y el Dr. Frank Marini me proporcionaron
algunos de los químicos necesarios para el estudio.
Con esto, la parte final de mi multiproyecto
de investigación de la calidad de agua de acuarios
de arrecife de varios años, agradezco especialmente
a mi esposa Roxie Fredrickson, por aguantar estas payasadas
y destinar algunos de nuestros magros ingresos a este esfuerzo.
|